Kennis van definisies in fisika is 'n sleutelfaktor vir die suksesvolle oplossing van verskeie fisiese probleme. In die artikel sal ons oorweeg wat bedoel word met isobariese, isochoriese, isotermiese en adiabatiese prosesse vir 'n ideale gasstelsel.
Ideale gas en sy vergelyking
Voordat ons voortgaan met die beskrywing van isobariese, isochoriese en isotermiese prosesse, kom ons kyk na wat 'n ideale gas is. Onder hierdie definisie in fisika beskou hulle 'n stelsel wat bestaan uit 'n groot aantal dimensielose en nie-interaksiedeeltjies wat teen hoë spoed in alle rigtings beweeg. Trouens, ons praat van 'n gasvormige aggregaattoestand van materie, waarin die afstande tussen atome en molekules hul groottes ver oorskry en waarin die potensiële energie van interaksie van deeltjies verwaarloos word as gevolg van sy kleinheid, in vergelyking met die kinetiese energie.
Die toestand van 'n ideale gas is die geheel van sy termodinamiese parameters. Die belangrikste is temperatuur, volume en druk. Kom ons dui hulle aan met die letters T, V en P, onderskeidelik. In die 30's van die XIX eeuClapeyron ('n Franse wetenskaplike) het eers 'n vergelyking neergeskryf wat die aangeduide termodinamiese parameters binne 'n enkele gelykheid kombineer. Dit lyk soos:
PV=nRT,
waar n en R onderskeidelik die hoeveelheid stowwe en die gaskonstante is.
Wat is isoprosesse in gasse?
Soos baie al opgemerk het, gebruik isobariese, isochoriese en isotermiese prosesse dieselfde "iso"-voorvoegsel in hul name. Dit beteken die gelykheid van een termodinamiese parameter tydens die verloop van die hele proses, terwyl die oorblywende parameters verander. Byvoorbeeld, 'n isotermiese proses dui aan dat die absolute temperatuur van die sisteem as gevolg daarvan konstant gehandhaaf word, terwyl 'n isochoriese proses 'n konstante volume aandui.
Isoprosesse is gerieflik om te bestudeer, aangesien die vasstelling van een van die termodinamiese parameters lei tot 'n vereenvoudiging van die algemene vergelyking van gastoestand. Dit is belangrik om daarop te let dat die gaswette vir al hierdie isoprosesse eksperimenteel ontdek is. Hulle ontleding het Clapeyron toegelaat om die verminderde universele vergelyking te verkry.
Isobariese, isochoriese en isotermiese prosesse
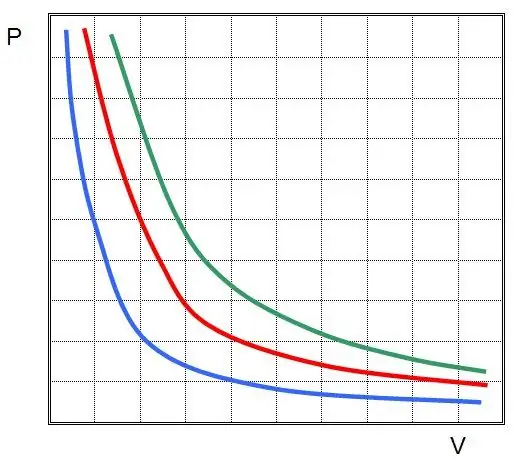
Die eerste wet is ontdek vir 'n isotermiese proses in 'n ideale gas. Nou word dit die Boyle-Mariotte-wet genoem. Aangesien T nie verander nie, impliseer die toestandsvergelyking die gelykheid:
PV=konst.
Met ander woorde, enige verandering in druk in die stelsel lei tot 'n omgekeerde proporsionele verandering in sy volume, as die temperatuur van die gas konstant gehandhaaf word. Die grafiek van die funksie P(V) ishiperbool.
Isobariese proses - dit is 'n verandering in die toestand van die stelsel, waarin die druk konstant bly. Nadat die waarde van P in die Clapeyron-vergelyking vasgestel is, kry ons die volgende wet:
V/T=konst.
Hierdie gelykheid dra die naam van die Franse fisikus Jacques Charles, wat dit aan die einde van die 18de eeu ontvang het. Die isobalk (grafiese voorstelling van die V(T)-funksie) lyk soos 'n reguit lyn. Hoe meer druk in die stelsel is, hoe vinniger styg hierdie lyn.
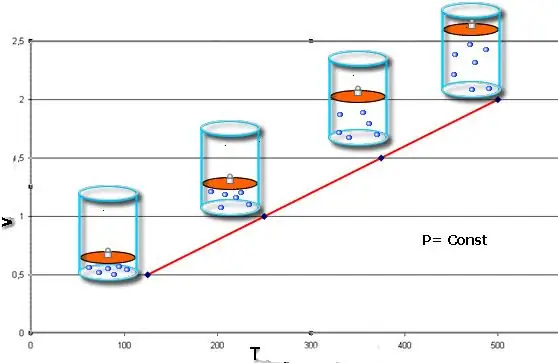
Die isobariese proses is maklik om te implementeer as die gas onder die suier verhit word. Die molekules van laasgenoemde verhoog hul spoed (kinetiese energie), skep 'n hoër druk op die suier, wat lei tot die uitbreiding van die gas en die handhawing van 'n konstante waarde van P.
Laastens, die derde isoproses is isochories. Dit loop met 'n konstante volume. Uit die toestandsvergelyking verkry ons die ooreenstemmende gelykheid:
P/T=konst.
Dit staan onder fisici bekend as Gay-Lussac se wet. Die direkte eweredigheid tussen druk en absolute temperatuur dui aan dat die grafiek van die isochoriese proses, soos die grafiek van die isobare proses, 'n reguit lyn met 'n positiewe helling is.
Dit is belangrik om te verstaan dat alle isoprosesse in geslote sisteme voorkom, dit wil sê die waarde van n word gedurende hul verloop bewaar.
Adiabatiese proses
Hierdie proses behoort nie aan die "iso"-kategorie nie, aangesien al drie termodinamiese parameters verander tydens die verloop daarvan. adiabatiesgenoem die oorgang tussen twee toestande van die sisteem, waarin dit nie hitte met die omgewing uitruil nie. Dus word die uitbreiding van die stelsel uitgevoer as gevolg van sy interne energiereserwes, wat lei tot 'n aansienlike daling in druk en absolute temperatuur daarin.
Adiabatiese proses vir 'n ideale gas word beskryf deur Poisson se vergelykings. Een van hulle word hieronder getoon:
PVγ=konst,
waar γ die verhouding van hittekapasiteite by konstante druk en by konstante volume is.
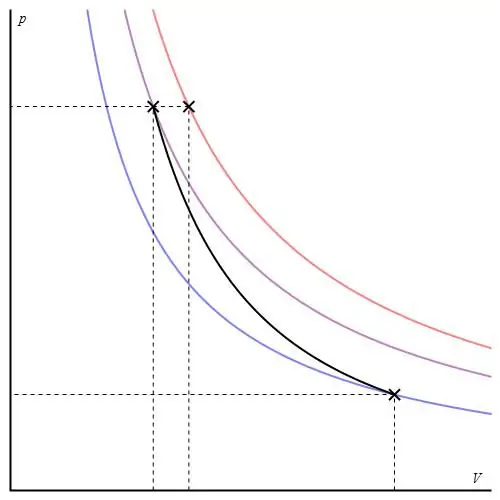
Die adiabatiese grafiek verskil van die isochoriese prosesgrafiek en van die isobariese grafiek, maar dit is soortgelyk aan 'n hiperbool (isoterm). Die adiabat in die P-V-asse tree skerper op as die isoterm.






