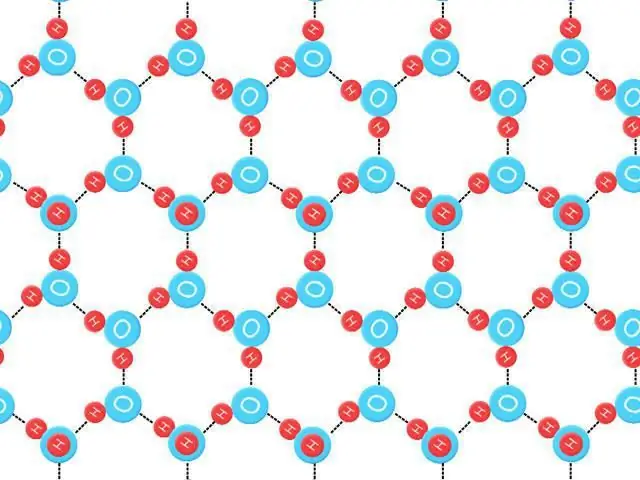
Die driedimensionele toestand van vloeibare water is moeilik om te bestudeer, maar baie is geleer deur die struktuur van yskristalle te ontleed. Vier naburige waterstof-interaksie suurstofatome beslaan die hoekpunte van 'n tetraëder (tetra=vier, hedron=vlak). Die gemiddelde energie wat benodig word om so 'n binding in ys te breek, word geskat op 23 kJ/mol-1.

Die vermoë van watermolekules om 'n gegewe aantal waterstofkettings te vorm, sowel as 'n gegewe sterkte, skep 'n buitengewoon hoë smeltpunt. Wanneer dit smelt, word dit vasgehou deur vloeibare water, waarvan die struktuur onreëlmatig is. Die meeste van die waterstofbindings is verwronge. Dit neem 'n groot hoeveelheid energie in die vorm van hitte om die kristalrooster van waterstofgebonde ys te breek.
Kenmerke van die voorkoms van ys (Ih)
Baie van die inwoners wonder watter soort kristalrooster ys het. NodigDaar moet kennis geneem word dat die digtheid van die meeste stowwe toeneem tydens vriesing, wanneer molekulêre bewegings vertraag en diggepakte kristalle vorm. Die digtheid van water neem ook toe namate dit afkoel tot 'n maksimum by 4°C (277K). Dan, wanneer die temperatuur onder hierdie waarde daal, brei dit uit.
Hierdie toename is as gevolg van die vorming van 'n oop, waterstofgebonde yskristal met sy rooster en laer digtheid, waarin elke watermolekule stewig gebind is deur bogenoemde element en vier ander waardes, terwyl dit vinnig genoeg beweeg om meer massa hê. Aangesien hierdie aksie plaasvind, vries die vloeistof van bo na onder. Dit het belangrike biologiese resultate, waardeur die laag ys op die dam lewende wesens weg van erge koue isoleer. Daarbenewens hou twee bykomende eienskappe van water verband met sy waterstofeienskappe: spesifieke hitte en verdamping.
Gedetailleerde beskrywing van strukture
Die eerste maatstaf is die hoeveelheid wat nodig is om die temperatuur van 1 gram van 'n stof met 1°C te verhoog. Die verhoging van die grade van water vereis 'n relatief groot hoeveelheid hitte omdat elke molekule betrokke is by talle waterstofbindings wat gebreek moet word sodat die kinetiese energie kan toeneem. Terloops, die oorvloed van H2O in die selle en weefsels van alle groot meersellige organismes beteken dat temperatuurskommelings binne die selle tot die minimum beperk word. Hierdie kenmerk is van kardinale belang, aangesien die tempo van die meeste biochemiese reaksiessensitief.
Die hitte van verdamping van water is ook aansienlik hoër as dié van baie ander vloeistowwe. 'n Groot hoeveelheid hitte word benodig om hierdie liggaam in 'n gas om te skakel, want die waterstofbindings moet verbreek word sodat die watermolekules van mekaar kan ontwrig en in die genoemde fase kan ingaan. Veranderbare liggame is permanente dipole en kan interaksie hê met ander soortgelyke verbindings en dié wat ioniseer en oplos.
Ander stowwe wat hierbo genoem word, kan slegs in aanraking kom as polariteit teenwoordig is. Dit is hierdie verbinding wat betrokke is by die struktuur van hierdie elemente. Daarbenewens kan dit in lyn wees rondom hierdie deeltjies wat uit elektroliete gevorm word, sodat die negatiewe suurstofatome van die watermolekules op die katione georiënteer is, en die positiewe ione en waterstofatome op die anione georiënteer is.
In vaste stowwe word as 'n reël molekulêre kristalroosters en atomiese roosters gevorm. Dit wil sê, as jodium op so 'n manier gebou is dat dit I2, bevat, dan is in vaste koolstofdioksied, dit wil sê in droë ys, CO2 molekules geleë by die kristalrooster nodusse . Wanneer dit met soortgelyke stowwe in wisselwerking tree, het ys 'n ioniese kristalrooster. Grafiet, byvoorbeeld, wat 'n atoomstruktuur het wat op koolstof gebaseer is, is nie in staat om dit te verander nie, net soos diamant.
Wat gebeur wanneer 'n kristal tafelsout in water oplos: polêre molekules word aangetrokke tot gelaaide elemente in die kristal, wat lei tot die vorming van soortgelyke deeltjies van natrium en chloried op sy oppervlak, wat lei tot hierdie liggameword van mekaar ontwrig, en dit begin oplos. Van hier af kan waargeneem word dat ys 'n kristalrooster met ioniese binding het. Elke opgeloste Na + trek die negatiewe punte van verskeie watermolekules aan, terwyl elke opgeloste Cl - die positiewe punte aantrek. Die dop wat elke ioon omring, word die ontsnapsfeer genoem en bevat gewoonlik verskeie lae oplosmiddeldeeltjies.
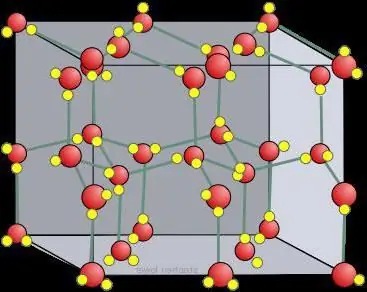
Droëys kristalrooster
Veranderlikes of 'n ioon wat deur elemente omring word, word gesê dat dit gesulfateer is. Wanneer die oplosmiddel water is, word sulke deeltjies gehidreer. So, enige polêre molekule is geneig om opgelos te word deur die elemente van die vloeibare liggaam. In droë ys vorm die tipe kristalrooster atoombindings in die toestand van aggregasie, wat onveranderd is. Nog iets is kristallyne ys (bevrore water). Ioniese organiese verbindings soos karboksilase en geprotoneerde amiene moet oplosbaar wees in hidroksiel- en karbonielgroepe. Die deeltjies in sulke strukture beweeg tussen molekules, en hul poolstelsels vorm waterstofbindings met hierdie liggaam.
Natuurlik beïnvloed die aantal van die laaste aangeduide groepe in 'n molekule die oplosbaarheid daarvan, wat ook afhang van die reaksie van verskeie strukture in die element: byvoorbeeld, een-, twee- en driekoolstofalkohole is mengbaar met water, maar groter koolwaterstowwe met enkele hidroksielverbindings is baie minder verdun in vloeistowwe.
Heksagonale Ih is soortgelyk in vorm aanatoomkristalrooster. Vir ys en alle natuurlike sneeu op aarde, lyk dit presies so. Dit word bewys deur die simmetrie van die kristalrooster van ys, gegroei uit waterdamp (dit wil sê sneeuvlokkies). Dit is in ruimtegroep P 63/mm vanaf 194; D 6h, Laue klas 6/mm; soortgelyk aan β-, wat 'n veelvoud van 6 heliese as het (rotasie rondom benewens skuif daarlangs). Dit het 'n redelik oop laedigtheidstruktuur waar die doeltreffendheid laag (~1/3) is in vergelyking met eenvoudige kubieke (~1/2) of gesiggesentreerde kubieke (~3/4) strukture.
In vergelyking met gewone ys, is die kristalrooster van droë ys, gebind deur CO2 molekules, staties en verander slegs wanneer atome verval.
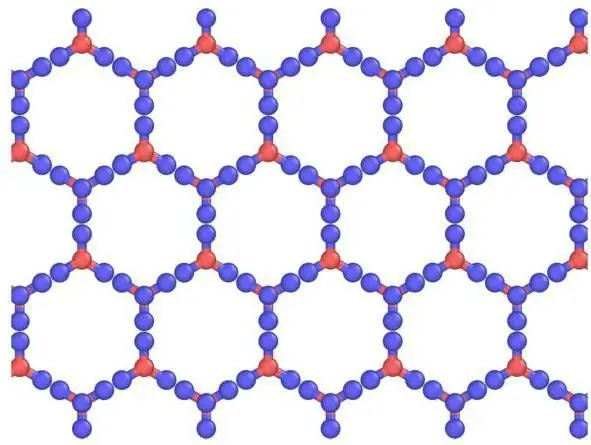
Beskrywing van tralies en hul elemente
Kristalle kan gesien word as kristallyne modelle wat bestaan uit velle wat bo-op mekaar geplaas is. Die waterstofbinding is georden, terwyl dit in werklikheid willekeurig is, aangesien protone tussen water (ys) molekules kan beweeg by temperature bo ongeveer 5 K. Dit is inderdaad waarskynlik dat protone soos 'n kwantumvloeistof in 'n konstante tonnelvloei optree. Dit word versterk deur die verstrooiing van neutrone, wat hul verstrooiingsdigtheid halfpad tussen die suurstofatome wys, wat lokalisering en gesamentlike beweging aandui. Hier is 'n ooreenkoms van ys met 'n atomiese, molekulêre kristalrooster.
Molekules het 'n verspringende rangskikking van die waterstofkettingmet betrekking tot sy drie bure in die vliegtuig. Die vierde element het 'n verduisterde waterstofbindingsrangskikking. Daar is 'n effense afwyking van perfekte seskantige simmetrie, aangesien die eenheidsel 0,3% korter is in die rigting van hierdie ketting. Alle molekules ervaar dieselfde molekulêre omgewings. Daar is genoeg spasie binne elke "boks" om deeltjies van interstisiële water te hou. Alhoewel dit nie algemeen oorweeg word nie, is hulle onlangs effektief opgespoor deur neutrondiffraksie van die poeieragtige kristalrooster van ys.
Changing Substances
Die seskantige liggaam het drievoudige punte met vloeibare en gasvormige water 0.01 ° C, 612 Pa, vaste elemente - drie -21.985 ° C, 209.9 MPa, elf en twee -199.8 ° C, 70 MPa, sowel as - 34,7 ° C, 212,9 MPa. Die diëlektriese konstante van seskantige ys is 97,5.
Die smeltkromme van hierdie element word deur MPa gegee. Die toestandsvergelykings is beskikbaar, benewens hulle, 'n paar eenvoudige ongelykhede wat die verandering in fisiese eienskappe in verband bring met die temperatuur van seskantige ys en sy waterige suspensies. Hardheid fluktueer met grade wat styg van of onder gips (≦2) by 0°C tot veldspaat (6 Mohs) by -80°C, 'n abnormaal groot verandering in absolute hardheid (> 24 keer).
Die seskantige kristalrooster van ys vorm seskantige plate en kolomme, waar die boonste en onderste vlakke die basale vlakke is {0 0 0 1} met 'n entalpie van 5,57 μJ cm -2, en ander ekwivalente sydele word dele van die prisma genoem {1 0 -1 0} met 5, 94µJ cm -2. Sekondêre oppervlaktes {1 1 -2 0} met 6.90 ΜJ ˣ cm -2 kan gevorm word langs die vlakke wat deur die kante van die strukture gevorm word.
So 'n struktuur toon 'n abnormale afname in termiese geleidingsvermoë met toenemende druk (sowel as kubieke en amorfe ys van lae digtheid), maar verskil van die meeste kristalle. Dit is as gevolg van 'n verandering in die waterstofbinding, wat die dwarsspoed van klank in die kristalrooster van ys en water verminder.
Daar is metodes wat beskryf hoe om groot kristalmonsters en enige gewenste ysoppervlak voor te berei. Daar word aanvaar dat die waterstofbinding op die oppervlak van die seskantige liggaam wat bestudeer word, meer georden sal wees as binne die grootmaatstelsel. Variasionele spektroskopie met fase-rooster frekwensie generering het getoon dat daar 'n strukturele asimmetrie tussen die twee boonste lae (L1 en L2) in die ondergrondse HO-ketting van die basale oppervlak van seskantige ys is. Die aangenome waterstofbindings in die boonste lae van die seshoeke (L1 O ··· HO L2) is sterker as dié wat in die tweede laag tot die boonste akkumulasie (L1 OH ··· O L2) aanvaar word. Interaktiewe seskantige ysstrukture beskikbaar.
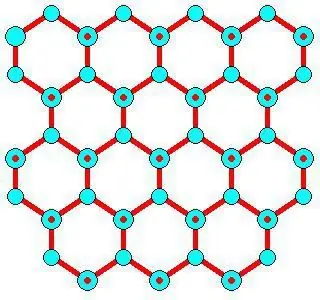
Ontwikkelingskenmerke
Die minimum aantal watermolekules wat nodig is om ys te vorm is ongeveer 275 ± 25, soos vir 'n volledige ikosaëdriese groep van 280. Vorming vind plaas teen 'n tempo van 10 10 by die lug-water-koppelvlak en nie in grootmaatwater nie. Die groei van yskristalle hang af van verskillende groeitempo's van verskillendeenergieë. Water moet teen bevriesing beskerm word wanneer biologiese monsters, voedsel en organe gekoel word.
Dit word tipies bereik deur vinnige afkoeltempo's, die gebruik van klein monsters en 'n kriokonservator, en verhoogde druk om ys te kern en selskade te voorkom. Die vrye energie van ys/vloeistof neem toe van ~30 mJ/m2 by atmosferiese druk tot 40 mJ/m-2 by 200 MPa, wat aandui rede waarom hierdie effek voorkom.
Watter tipe kristalrooster is kenmerkend van ys
Alternatiewelik kan hulle vinniger groei vanaf prisma-oppervlaktes (S2), op die lukraak versteurde oppervlak van kitsbevrore of geroerde mere. Die groei van die {1 1 -2 0} vlakke is ten minste dieselfde, maar verander hulle in prismabasisse. Die data oor die ontwikkeling van die yskristal is volledig ondersoek. Die relatiewe groeitempo van elemente van verskillende gesigte hang af van die vermoë om 'n groot mate van gewrighidrasie te vorm. Die temperatuur (laag) van die omliggende water bepaal die mate van vertakking in die yskristal. Deeltjiegroei word beperk deur die diffusietempo by 'n lae graad van onderverkoeling, d.w.s. <2 ° C, wat meer daarvan tot gevolg het.

Maar beperk deur ontwikkelingskinetika by hoër vlakke van depressie van >4°C, wat lei tot naaldgroei. Hierdie vorm is soortgelyk aan die struktuur van droë ys (het 'n kristalrooster met 'n seskantige struktuur), verskeiekenmerke van oppervlakontwikkeling en die temperatuur van die omliggende (onderverkoelde) water, wat agter die plat vorms van sneeuvlokkies is.
Die vorming van ys in die atmosfeer beïnvloed die vorming en eienskappe van wolke ingrypend. Veldspate, gevind in woestynstof wat in miljoene ton per jaar die atmosfeer binnedring, is belangrike vormers. Rekenaarsimulasies het getoon dat dit te wyte is aan die kernvorming van prismatiese yskristalvlakke op hoë-energie oppervlakvlakke.
Sommige ander elemente en traliewerk
Opgeloste stowwe (met die uitsondering van baie klein helium en waterstof, wat die tussenruimtes kan binnedring) kan nie by die Ih-struktuur by atmosferiese druk ingesluit word nie, maar word na die oppervlak of amorfe laag tussen die deeltjies van die mikrokristallyne liggaam. Daar is 'n paar ander elemente by die roosterplekke van droë ys: chaotropiese ione soos NH4 + en Cl - wat by ligter vloeibare vriesing ingesluit is as ander kosmotropiese vriesings soos Na + en SO42-, dus is dit nie moontlik om hulle te verwyder nie as gevolg van die feit dat hulle 'n dun film van die oorblywende vloeistof tussen die kristalle vorm. Dit kan lei tot elektriese laai van die oppervlak as gevolg van dissosiasie van oppervlakwater wat die oorblywende ladings balanseer (wat ook kan lei tot magnetiese straling) en 'n verandering in die pH van die oorblywende vloeistoffilms, bv. NH 42SO4 word suurder en NaCl word meer basies.
Hulle is loodreg op die gesigtekristalrooster van ys wat die volgende laag aangeheg wys (met O-atome in swart). Hulle word gekenmerk deur 'n stadig groeiende basale oppervlak {0 0 0 1}, waar slegs geïsoleerde watermolekules geheg is. 'n Vinnig groeiende {1 0 -1 0} oppervlak van 'n prisma waar pare nuutgehegte deeltjies met waterstof aan mekaar kan bind (een waterstofbinding/twee molekules van 'n element). Die vinnigste groeiende gesig is {1 1 -2 0} (sekondêre prismaties), waar kettings van nuutgehegte deeltjies met mekaar in wisselwerking kan tree deur waterstofbinding. Een van haar kettings/elementmolekule is 'n vorm wat rante vorm wat verdeel en transformasie in twee kante van die prisma aanmoedig.
Nulpunt-entropie
Kan gedefinieer word as S 0=k B ˣ Ln (N E0), waar k B die Boltzmann-konstante is, NE die aantal konfigurasies by die energie E is, en E0 die laagste energie is. Hierdie waarde vir die entropie van seskantige ys by nul Kelvin oortree nie die derde wet van termodinamika "Die entropie van 'n ideale kristal by absolute nul is presies nul", aangesien hierdie elemente en deeltjies nie ideaal is nie, het wanordelike waterstofbinding.
In hierdie liggaam is die waterstofbinding ewekansig en verander vinnig. Hierdie strukture is nie presies gelyk in energie nie, maar strek tot 'n baie groot aantal energeties naby toestande, gehoorsaam die "reëls van ys". Nulpunt-entropie is die versteuring wat sou bly selfs as die materiaal tot absoluut afgekoel kon wordnul (0 K=-273, 15 ° C). Genereer eksperimentele verwarring vir seskantige ys 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoreties sou dit moontlik wees om die nul-entropie van bekende yskristalle met baie groter akkuraatheid te bereken (verwaarloos defekte en energievlakverspreiding) as om dit eksperimenteel te bepaal.
Wetenskaplikes en hul werk in hierdie area
Kan gedefinieer word as S 0=k B ˣ Ln (N E0), waar k B die Boltzmann-konstante is, NE die aantal konfigurasies by die energie E is, en E0 die laagste energie is. Hierdie waarde vir die entropie van seskantige ys by nul Kelvin oortree nie die derde wet van termodinamika "Die entropie van 'n ideale kristal by absolute nul is presies nul", aangesien hierdie elemente en deeltjies nie ideaal is nie, het wanordelike waterstofbinding.
In hierdie liggaam is die waterstofbinding ewekansig en verander vinnig. Hierdie strukture is nie presies gelyk in energie nie, maar strek tot 'n baie groot aantal energeties naby toestande, gehoorsaam die "reëls van ys". Nulpunt-entropie is die wanorde wat sou bly selfs as die materiaal tot absolute nul afgekoel kon word (0 K=-273.15°C). Genereer eksperimentele verwarring vir seskantige ys 3, 41 (± 0, 2) ˣ mol -1 ˣ K -1. Teoreties sou dit moontlik wees om die nul-entropie van bekende yskristalle met baie groter akkuraatheid te bereken (verwaarloos defekte en energievlakverspreiding) as om dit eksperimenteel te bepaal.

Alhoewel die volgorde van protone in grootmaat ys nie georden is nie, verkies die oppervlak waarskynlik die volgorde van hierdie deeltjies in die vorm van bande van hangende H-atome en O-enkelpare (nul entropie met geordende waterstofbindings). Die nulpuntversteuring ZPE, J ˣ mol -1 ˣ K -1 en ander word gevind. Uit al die bogenoemde is dit duidelik en verstaanbaar watter soorte kristalroosters kenmerkend van ys is.






